先日、後輩薬剤師に質問されたことです。
今回は後発品変更のルールについてのお話です。
後発品変更についてお悩みの方の参考になれば幸いです。
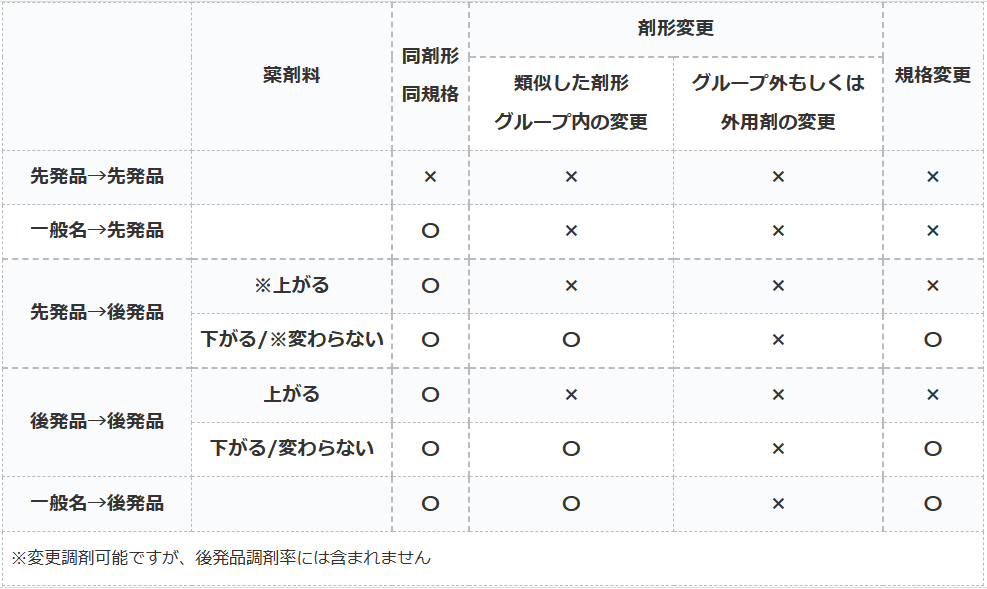
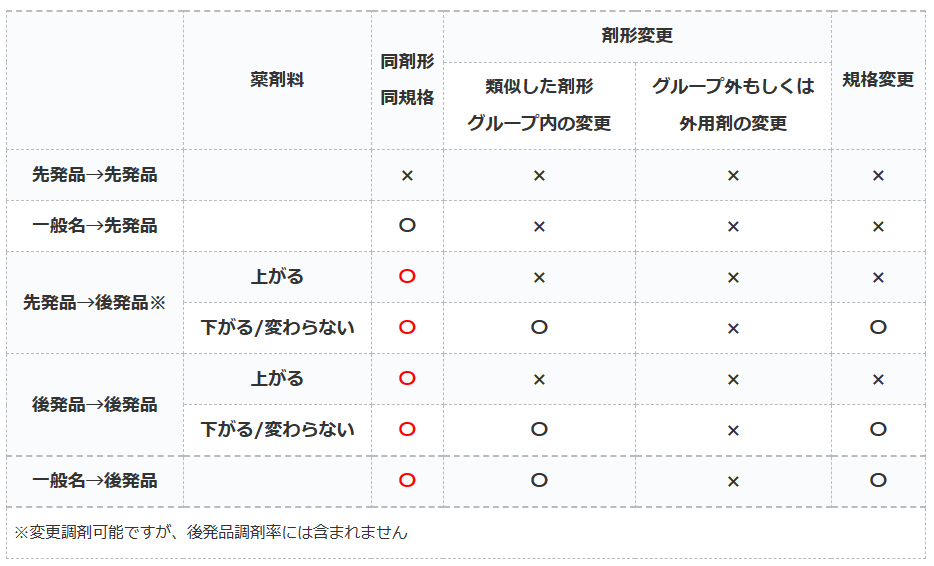
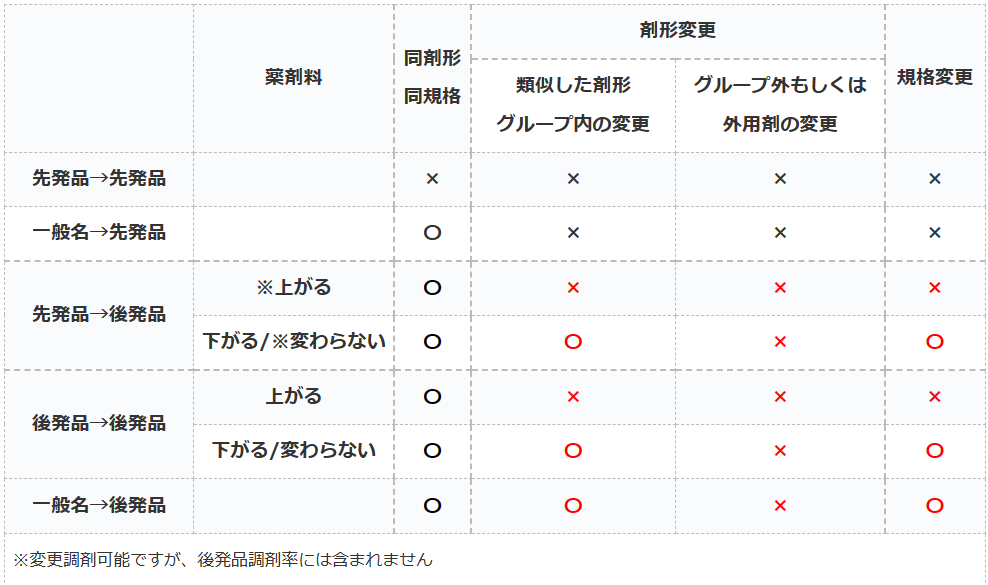
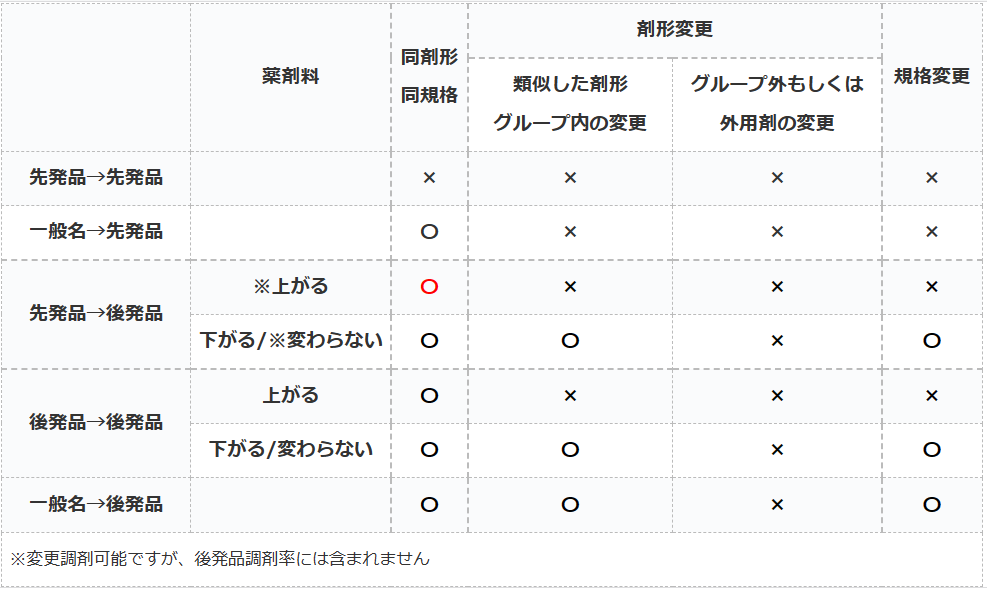
後発品変更のルール
- 〇→処方医の確認なしに変更可能
- ×→処方医の確認なしで変更不可
後発品変更のルールとは、処方せんに記載されている薬を先発品や後発品に変更する際の医師確認のルールのことです。
多くのケースでは患者の同意を得られれば、薬局側の判断で処方薬を後発品で調剤しても良いことになっています。
しかし、一定の条件下では患者が同意していても医師に確認しなければ後発品へ変更出来ないルールがあります。
同剤形・同規格
変更後のお薬が後発品であれば、薬剤料が上がろうが銘柄が変わろうが関係ありません。
『同剤形・同規格での後発品変更であれば確認必要なし』
と覚えておくと現場で混乱しにくくなります(‘ω’)
剤形変更/規格変更
基本的に別剤形に変更する時の薬剤料が上がるか否かでの混乱が最も多いと思います。
先発品への変更の場合は、どのような場合でも剤形変更する時は医師確認が必要です。
『類似した剤形グループ内の変更』の『グループ内』とは以下を指します。
イ 散剤、顆粒剤、細粒剤、末剤、ドライシロップ剤(内服用固形剤として調剤する場合に限る。)
ウ 液剤、シロップ剤、ドライシロップ剤(内服用液剤として調剤する場合に限る。)
現場として多いのは、処方せんに『一般名』ではなく『後発品』として記載されている場合です。
後発品から後発品に変更する場合は、『類似した剤形グループ内の変更』であれば薬剤料が上がる場合には医師確認が必要になります。
しかし、一般名から後発品に変更する場合は、『類似した剤形グループ内の変更』で薬剤料が上がる場合でも医師確認が不要となります。

現場で多いのは、普通錠↔OD錠やカプセル↔OD錠などですね。
外用薬は適用されず
『類似した剤形グループ』は、外用薬に関しては適用されません。
なので、『後発:○○軟膏』から『後発:○○クリーム』などへは変更には必ず医師確認が必要になりますので、ご注意ください。
規格変更に関しては原則として『類似した剤形グループ内の変更』と条件が同じですので割愛します(;^ω^)
後発品?一般名?
現場でややこしいのは処方せんに記載の薬が『後発品』なのか『一般名』なのかわからない時があるケースです。
『一般名』の【般】記載なしだけど、『銘柄名』の記載もない書き方の時ですね(;^ω^)
『後発品』:アムロジピン錠5mg「サワイ」
『一般名』:【般】アムロジピンベシル酸塩錠5mg
どちらか迷う:アムロジピン錠5mg
私の薬局では、
- 『銘柄名』までキチンと記載していれば『後発品』
- 有効成分までで記載が終わっている場合は『一般名』
として扱っています( 一一)
ちなみに稀に先発品から後発品に変えることで薬剤料が上がることがあります。
同剤形/同規格であれば、薬剤料が上がっていても変更後が後発品ですので、医師確認は不要です(‘ω’)ノ。
原則として後発品変更したら医師への報告は必要。
忘れがちなのが、どのようなケースであれ処方せん薬を後発品で調剤したら医師への報告が必要です。
ただし、あくまで原則で事前に医師と相談し省略することも出来ます。
うちの薬局でも必要がなければ医師に報告してません。
医師側も処方せんで後発品変更可扱いとしてるのに、後発品の報告貰ってもあんまり使い道ないですしね(^^;
逆に医師と相談して報告しているケースもあります。
その場合は医師との決め事になりますが、多くは月に1度リスト化してFAXしてるケースがほとんどです。
最後に
後発品変更のルールは色々なケースがあって混乱しますね(^^;
私も混乱したら表を見ながら対処してます。
後発品変更についてお悩みの方の参考になれば幸いです。
ではでは。